合成生物技术重塑中药产业的四大战略路径
添加时间:2025-08-18 点击次数:960
中药活性成分主要以药效分子群的形式达成治疗效果,但目前中药活性成分异源合成大多以生产单一产物为目标,实现多种组分在同一仿生细胞中的一站式合成将显著提高生产通量。通过构建前体充足的底盘菌,重建多个产物的异源合成途径,调控代谢网络,协调各组分产量,建立生产多组分复杂产物的微生物仿生细胞,将是中药活性成分异源合成的重要发展方向。
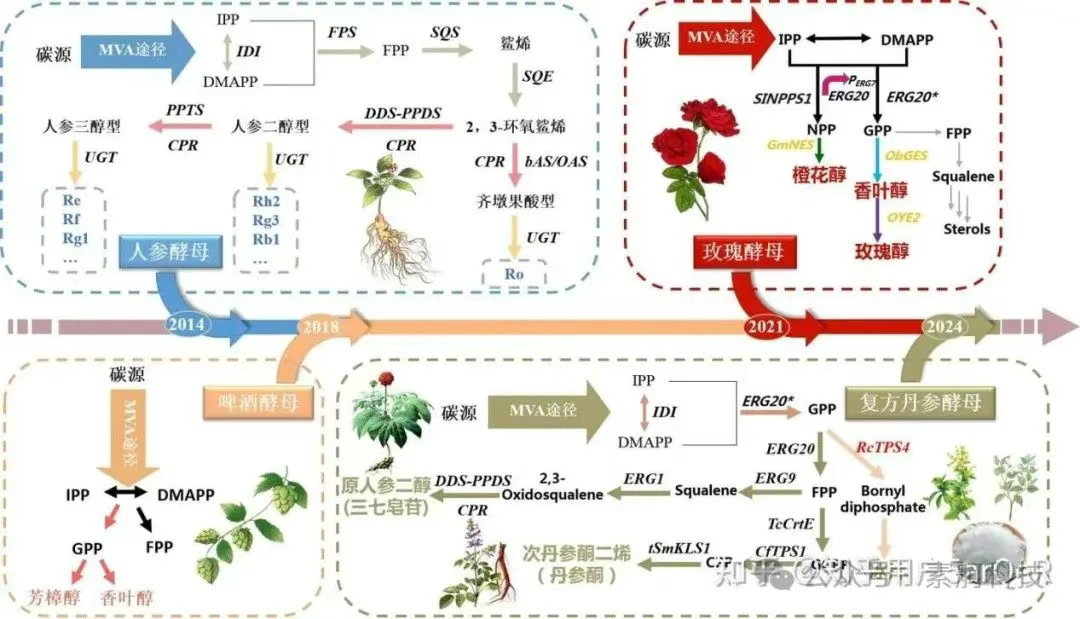
图:中药复杂组分的仿生合成案例
1、人参酵母
“人参酵母”的创建是创建微生物仿生细胞生产单一产物到多个复杂组分的一次突破性尝试。目前已发现人参皂苷超过100种,按照皂苷元结构可分为三种类型,即齐墩果酸型(oleanolic acid, OA)、人参二醇型(PPD)以及人参三醇型(PPT)。2014年,团队与中国中医科学院中药资源中心合作,首先构建了高产β-香树脂的酵母菌株,再以此菌株作为底盘菌,引入了异源的齐墩果酸合酶、达玛烯二醇-Ⅱ合酶、原人参二醇合酶、原人参三醇合酶和NADPH-细胞色素P450还原酶等关键基因,在酿酒酵母中重建了OA、PPD和PPT异源合成途径,获得“人参酵母”仿生细胞GY-1。该仿生细胞的构建完成了在同一细胞中同时生产三种类型人参皂苷的突破,产量为齐墩果酸21.4 mg·L-1、原人参二醇17.2 mg·L-1、原人参三醇15.9 mg·L-1,三者占人参皂苷元的比例为39.3%、31.5%、29.2%,为人参皂苷组分的生产提供了新的解决方案。
2、啤酒酵母
2018年,Keasling团队改造酿酒酵母,获得了可同时产生芳樟醇和香叶醇的“啤酒酵母”,也是生产多组分微生物仿生细胞成功构建的实例。这两种单萜的比例和含量是决定啤酒花风味的主要因素。为精准控制芳樟醇和香叶醇达到预期产量,研究者利用不同强度的启动子驱动关键基因的表达,并建立数学模型辅助预测单萜产量,最终获得的“啤酒酵母”可在不添加啤酒花的前提下,生产的啤酒比传统方式酿造的更有酒花味。研究者指出芳樟醇和香叶醇虽然可以产生酒花味,但要想获得酒花的全部风味还需要更多风味物质的组合。
3、玫瑰酵母
2021年,有研究团队创建了同时生产天然玫瑰精油三种主要单萜组分的“玫瑰酵母”菌株Rose-Yeast 1.0。天然玫瑰精油的三种主要组分为玫瑰醇、香叶醇和橙花醇。研究者首先通过更换启动子元件、优化代谢途径等策略构建了玫瑰醇的高产菌株,玫瑰醇的发酵罐产量可达6 g·L-1。然后在此基础上引入香叶醇-玫瑰醇合成模块和橙花醇合成模块,最终三种单萜总产量为120 mg·L-1,其中玫瑰醇、香叶醇、橙花醇的比例为62%、27%、10%,与天然大马士革玫瑰精油中三种组分的比例接近,在国际标准认证ISO 9842, 2003范围内。Rose-Yeast 1.0在5 L发酵罐中混合精油产量能达到5 g·L-1,预计未来综合成本将节约90 %。此研究为多组分芳香精油的异源合成奠定了坚实的基础。
4、复方丹参酵母
复方丹参是临床常用的治疗冠心病、心绞痛的中药复方制剂,其主要组成为丹参、三七和冰片。丹参的主要活性成分为丹参酮和酚酸类,三七的主要活性成分为三七总皂苷,冰片为辅药具有开窍醒神、清热止痛功效。2024年,戴住波团队通过中药活性成分异源仿生合成技术,在酿酒酵母中实现了三七总皂苷的生物合成前体原人参二醇、丹参酮生物合成前体次丹参酮二烯以及冰片在同一酵母细胞内的同时合成,构建了复方丹参仿生合成细胞——复方丹参酵母1.0。该仿生细胞能够同时生产62.34 mg/L的原人参二醇、12.82 mg/L的次丹参酮二烯以及2.54 mg/L的冰片。该研究在建立仿生细胞进行的单体、组分高效合成的基础上,进一步过渡到跨物种、多组分仿生合成的首次尝试,为中药复方一站式发酵生产奠定了基础。
中药活性成分的异源合成正经历从“单一产物生产”向“多组分仿生合成”的范式跃迁。人参酵母(同时产出三类皂苷元)、复方丹参酵母(跨物种合成三七皂苷+丹参酮+冰片)等突破性案例,标志着中药活性成分制造进入“微生物药厂”时代。当传统中药面临资源枯竭、成分波动等困局时,合成生物学通过底盘细胞重构+代谢网络调控,不仅实现复杂组分的精准复刻,更将生产成本大幅压缩。这场技术革命正彻底改写中药产业的底层逻辑。
一、组分协同合成:破解中药复方“黑箱”的钥匙
复方丹参酵母1.0的划时代意义在于首次实现跨物种活性成分协同表达:在单细胞中同步产出原人参二醇(62.34 mg/L)、次丹参酮二烯(12.82 mg/L)及冰片(2.54 mg/L),精准模拟了原方“活血化瘀-通脉止痛”的君臣佐使配伍。这揭示中药创新的核心路径——必须建立“化学组分-代谢通路-药效机制”的映射模型。例如丹参酮与三七皂苷协同可激活PI3K/Akt通路,而冰片作为“药引”能增强血脑屏障透过率。未来需构建三大数据库:①中药组分代谢途径库(如人参皂苷生物合成基因簇);②组分互作药效网络(类似STRING数据库);③临床适应症-通路关联图谱。只有当机器能自主优化“君药:臣药”产量比,才能真正解开千年经方的科学密码。
二、生物智造体系:从资源依赖到技术驱动的产业跃迁
玫瑰酵母5 g/L的精油产量与90%成本降幅,直击中药产业最大痛点——资源约束。野山参需生长7年方达药典标准,而人参酵母72小时发酵即产出等量皂苷;天然冰片依赖龙脑香树,微生物合成却可无限扩增。这要求企业重构生产模式:纵向整合“菌种-工艺-工厂”:借鉴连续流生物合成技术,将发酵周期大幅压缩;建立细胞工厂GMP标准:如规定底盘菌基因稳定性≥99.99%(避免生产漂移);开发AI驱动的代谢预测模型:可提前预警产量波动。当冬虫夏草因过度采挖濒临灭绝时,合成虫草素菌株或是唯一可持续方案。未来十年,“没有种植基地的生物药企”将成为主流。
三、标准化革命:从经验质控到数字溯源的范式颠覆
传统中药质量控制依赖“指纹图谱+指标成分”,但人参皂苷Rg1/Rb1比例波动常导致药效差异。而人参酵母通过启动子强度梯度调控,使三类皂苷元比例稳定。这提示行业:必须建立“合成生物学质控新三角”:基因电路稳定性监测(如sgRNA编辑效率实时追踪)、代谢流动态平衡模型(类似Rose-Yeast的产量预测算法)、区块链组分溯源系统(从基因序列到灌装批号全流程上链)。
四、生态共赢:从封闭研发到开放创新的范式重构
Keasling团队开发啤酒酵母时,开源了单萜调控数学模型,促使全球多个实验室共同优化产量。这揭示合成生物中药的未来在于构建开放创新生态。共享底盘细胞库,如上海交大建设的“本草酵母”平台(含48种药用植物代谢模块);成立专利池联盟,借鉴MPEG-LA模式,交叉许可关键基因编辑工具(如CRISPR-Cas12f1);打造云试验平台,客户可远程验证菌株性能。当行业从“秘方保护”转向“模块共享”,中药才能真正驶入创新快车道。

